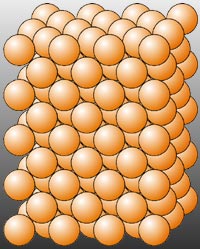
Estructura de la red cristalina del cobre: los iones cobre (Cu2+) se hallan ordenados regularmente
Sus unidades estructurales son electrones y cationes, que pueden tener cargas de +1, +2 o +3. Los cristales metálicos están formados por un conjunto ordenado de iones positivos, por ejemplo, Na+, Mg2+, Cu2+. Estos iones están anclados en su posición, como boyas en un "mar" móvil de electrones. Estos electrones no están sujetos a ningún ion positivo concreto, sino que pueden deambular a través del cristal. Esta estructura explica muchas de las propiedades características de los metales:
1. Conductividad eléctrica elevada. La presencia de un gran número de electrones móviles explica por qué los metales tienen conductividades eléctricas varios cientos de veces mayores que los no metales. La plata es el mejor conductor eléctrico pero es demasiado caro para uso normal. El cobre, con una conductividad cercana a la de la plata, es el metal utilizado habitualmente para cables eléctricos.
2. Buenos conductores del calor. El calor se transporta a través de los metales por las colisiones entre electrones, que se producen con mucha frecuencia.
3. Ductilidad y maleabilidad. La mayoría de los metales son dúctiles (capaces de ser estirados para obtener cables) y maleables (capaces de ser trabajados con martillos en láminas delgadas). En un metal, los electrones actúan como un pegamento flexible que mantiene los núcleos atómicos juntos, los cuales pueden desplazarse unos sobre otros. Como consecuencia de ello, los cristales metálicos se pueden deformar sin romperse.